![]() 西北农林科技大学《食品生物工程》拓展学习资料
西北农林科技大学《食品生物工程》拓展学习资料
基于酶工程优化胶原蛋白生产应用
关键词:酶工程;酶水解;酶交联;胶原蛋白
一、 引言
胶原蛋白作为一种重要的结构性蛋白质,在人体和动物组织中广泛存在,具有良好的生物相容性和生物降解性(Tang et al. 2022)。胶原蛋白在皮肤修复、关节保健、食品增稠等方面都发挥着重要作用(EVA et al. 2023),故其在医药、保健品和食品工业具有广泛的应用前景。然而,由于传统的胶原蛋白提取技术提取后的胶原蛋白存在一些缺点,如热稳定性差、生物活性低等,导致胶原蛋白的应用存在一定的局限性(王欣慧等 2024)。
酶是一种由生物体产生的、有催化作用的蛋白质,具有显著的高效性和专一性,其作为一种高效的催化剂已经得到大规模的应用(王艳菊 2022)。酶工程技术是利用生物催化剂(酶)进行特定化学反应的工程技术,在胶原蛋白中,酶工程技术的应用可以改变其结构和性质,为胶原蛋白的改性和功能化提供新的思路和途径,扩展其在食品工程和医药领域的应用。
本文基于酶工程技术的基础,分别以基于酶水解的胶原蛋白、基于酶交联的胶原蛋白两个案例来分析胶原蛋白结合酶工程在食品工程中的技术原理、生产流程、产业现状和发展前景等,为优化胶原蛋白生产提供理论依据。
二、 基于酶水解的胶原蛋白
2.1技术原理
胶原蛋白均是由三条左旋多肽长链在分子间氢键、范德华力等相互作用下形成的右旋型超螺旋蛋白,在其分子结构中含有大量的脯氨酸、羟脯氨酸和甘氨酸等。酶水解作为一种常用的蛋白改性方法,主要是通过酶的作用,将胶原蛋白分解为较低分子量的多肽片段或氨基酸,从而改善其溶解性、生物活性和功能性。
水解胶原蛋白的主要酶是胶原蛋白酶,能够专门降解Ⅰ型胶原蛋白与Ⅱ型胶原蛋白。胶原蛋白酶主要包括基质金属蛋白酶(matrix metalloproteinase, MMP)和微生物胶原蛋白酶(bacterial collagenase)二类,它们能够选择性地作用于胶原蛋白分子中的特定位点,断裂肽链,形成具有不同生物活性的肽段。
2.1.1 MMP
MMP主要来源于脊椎动物基质细胞、上皮细胞及巨噬细胞等分泌,主要包括胶原蛋白酶型(MMP-1、MMP-8、MMP-13);明胶酶型(MMP-2、MMP-9);间质溶解素(MMP-3、MMP-10)等。MMP仅作用于胶原蛋白N端3/4处的Gly-Ile和Gly-Lue肽键,形成典型的1/4和3/4多肽片段。
2.1.2 微生物胶原蛋白酶
微生物胶原蛋白酶主要来源于胶原蛋白酶产生菌,如产气荚膜梭菌、溶组织梭菌、芽孢杆菌、枯草芽孢杆菌等。这些菌种均可分泌胶原蛋白酶,但结构上略有差异。其水解过程大体分为两步:第一步微生物胶原酶通过多组功能域与(纤维状)胶原蛋白结合,胶原酶逐渐由松弛构型变为闭合构型,如图1(a)、(b)、(d)、(e)所示。第二步胶原酶恢复半开-半闭构型过程中,(纤维状)胶原蛋白在强结合力作用下被解旋,其二级结构暴露在活性位点下完成水解,如图1(c)、(f)所示。此时胶原蛋白被解旋酶解,胶原酶也随之恢复松弛构型,(纤维状)胶原蛋白未解旋的其余部分或尚未水解的可进行下一轮水解开始新一周期(Eckhard U et al. 2011)。
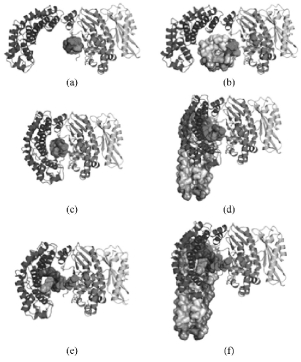
图1 胶原蛋白及纤维状胶原蛋白被胶原酶水解示意图
Fig.1 Collagenolysis process model of triple-helical and microfibrillar collagen
2.2生产流程
近年来,胶原蛋白多肽类食品作为保健类食品畅销不衰。胶原蛋白酶水解的生产工艺一般包括原料预处理、酶水解、反应控制和产物提取等步骤。首先,选择优质的胶原蛋白原料,如动物皮肤、鱼鳞或骨骼等。然后,在适宜的温度、pH和酶浓度条件下,将酶与原料进行反应。控制反应时间和条件,达到所需水解程度。最后,通过过滤、浓缩和干燥等工艺步骤,提取水解产物。下以鱼皮胶原蛋白多肽的制备为例,简述其生产流程(全盈园 2018)。
2.2.1 原料预处理
将鱼皮切碎后,组织捣碎。按料液比为1:4-6 g/mL将鱼皮加入浓度为0.08-0.13M的氧氧化钠溶液中,浸泡并不断搅动,1.5-2.5h后用流动水冲洗至中性,再按料液比为1:1.5-2.5g/mL经异丙醇溶液处理。
2.2.2 制备胶原蛋白粉
预处理后鱼皮酸提取,得到胶原蛋白粉。
2.2.3 酶解
胶原蛋白粉再经胶原酶和风味蛋白酶酶解。酶解过程中用超滤膜超滤,即得超滤液。
2.2.4 脱色
将超滤液中加入改性活性炭,超声波搅拌,过滤,得到清滤液。温度为50-70 ℃,pH为5-7,改性活性炭的添加量为胶原蛋白重量的1-3%,时间为20-40 min。
所述改性活性炭的制备方法为:按料液比为1:8-12 g/mL将活性炭放入浓度为0.8-1.2 M的氧氧化钠溶液中浸泡45-50 h,洗涤,再将活性炭放入含有柠檬黄和苯甲酸钠的乙酸乙酯中,在75-85 ℃下搅拌45-50 h,干燥,即得改性活性炭。
2.2.4 制备鱼皮胶原多肽
将清滤液经纳滤膜纳滤,获得浓缩多肽液,冷冻干燥即得鱼皮胶原多肽。
2.3产业现状
目前,基于MMP与微生物胶原蛋白酶水解的胶原蛋白产物在在医药、保健品和食品工业等领域具有广泛的应用。
在医药方面,水解胶原蛋白可以用于制备伤口敷料、生物胶原膜和修复组织工程等。
在保健品方面,水解胶原蛋白常用于制备蛋白质营养补充剂,具有增强骨骼健康、促进关节功能和美容护肤等功效。
在食品工业方面,胶原蛋白氨基酸种类丰富,包含多种人体必需氨基酸,是理想的氨基酸来源补充。胶原蛋白经热水解或碱、酶部分水解处理可制成常见的水凝胶物质明胶(部分解旋),可用作食品、乳化剂、发泡剂、胶质稳定剂、絮凝剂、生物降解包装材料及微胶囊等。此外,由胶原蛋白制备的功能肽被证明具有促进促炎细胞因子产生、改善骨质疏松类疾病、改善紫外线过度照射皮肤病(Hu H et al. 2012)、对革兰氏细菌有一定的抗菌活性(Patrzykat A and Douglas S E 2009)、具有抗氧化活性、具有无明显副作用抗高血压疾病等功能。多年来研究者尝试在不同处理环境下使用各类蛋白酶及胶原酶等处理明胶或胶原蛋白,而胶原酶因特异性强、处理效果好且本身用途较为广泛而备受关注。目前,胶原蛋白酶已经广泛应用在奶酪制造、低敏婴儿食品、肉类嫩化等诸多方面。
2.4发展前景
对于胶原蛋白肽而言,选择原料来源至关重要。由于不同原料之间的组成差异,导致其蛋白降解后多肽展现出诸如抗氧化、抗高血压、抗菌杀毒等不同特性,未来可尝试胶原蛋白酶水解多种来源的胶原蛋白探究其效果。同时,基于酶水解生成的胶原蛋白多肽未来可开发应用于化妆品行业等领域的其他产品。
三、 基于酶交联的胶原蛋白
由于胶原蛋白对外界的高温或酶的耐久性较低,因此需要稳定其结构。改善胶原结构的方法有物理方法、化学方法和生物方法。物理交联可避免毒性物质进入胶原蛋白分子内,但形成的分子结构稳定性差,交联度较低。化学试剂可以提高交联度,但通常存在有毒或生物不相容等问题。生物交联胶原具有较低的细胞毒性、优异的细胞相容性,且不易产生胶原变性。在生物交联胶原中,酶交联技术十分重要(王欣慧等 2024)。
3.1技术原理
胶原蛋白酶交联是利用特定的酶对胶原蛋白进行化学交联反应,增强其稳定性和机械性能的过程。常用的酶包括交联酶、谷胱甘肽过氧化物酶等,它们作用于胶原蛋白分子中的特定基团,形成交联结构,增加胶原蛋白的结构稳定性和生物相容性。
3.1.1赖氨酰氧化酶(LOX)
赖氨酰氧化酶(LOX)是一种催化胶原蛋白和弹性蛋白的共价键的蛋白酶,LOX可以氧化胶原蛋白和弹性蛋白中的侧链赖氨酸残基形成醛,其中醛可自发反应形成共价交联(SHARMA 2023)。
3.1.2微生物谷氨酰胺转胺酶(MTG)
MTG是一种具有良好生物相容性的食品级酶,被广泛应用于食品工业中。MTG可以改善蛋白质基材料的物理性能,因此在蛋白质基材料中得到了广泛的应用。MTG的主要作用机理是催化肽结合谷氨酰胺残基的γ-羧酰胺基团(酰基供体)与主要赖氨酸残基的ε-氨基(酰基受体)之间的酰基转移反应,产生分子间或分子内的ε-(γ-谷氨酰)赖氨酸键,增加机械和蛋白水解抗性而不产生细胞毒性。试验结果表明,无论酶的来源是哺乳动物或是微生物,以及胶原蛋白的种类是I型或是II型,谷氨酰胺转氨酶(MTG)的交联仅可以小幅提高胶原蛋白的变性温度、机械强度以及生物学稳定性(BUSCAGLIA et al. 2022)。
3.2生产流程
胶原蛋白酶交联的生产工艺一般包括原料准备、交联反应、控制条件和产物处理等步骤。首先,选择适宜的胶原蛋白原料,如动物皮肤或鱼鳞等。然后,在特定的温度、pH和酶浓度条件下,进行酶交联反应,控制反应时间和条件以达到预期的交联程度。最后,通过洗涤、干燥和形状修整等工艺步骤,得到交联胶原蛋白产物。下以胶原蛋白纤维—明胶交联可食用膜为例,简述其生产流程(高贵贤 2018)。
3.2.1酸胀胶原蛋白团和成膜液的制备
用蒸馏水将碱处理过的牛皮清洗浸泡直到pH值接近于7,然后将中性的牛皮完全浸泡在0.01 M盐酸溶液中进行酸胀,酸胀完全的牛皮用镊子从外皮上剥离下纤维状的胶原,用研钵研磨和剪刀剪切尽量使胶原纤维分散均匀(测得胶原蛋白的干物质含量为6%),然后将蛋白团分散于蒸馏水中配成1.0 wt%、pH为2的胶原纤维悬浮液。
3.2.2酶处理胶原悬浮液
取胶原悬浮液,25 ℃下处理4h,pH值调整至6,达到谷氨酰胺转氨酶的最佳反应条件。随后,将谷氨酰胺转氨酶(20 U/g胶原纤维干物质)分别添加到不同温度处理的悬浮液中,室温下反应24 h。
3.2.3胶原蛋白纤维—明胶交联可食用膜的制备
取25℃处理的胶原纤维成膜液与相同干物质含量的明胶成膜液混合,复合成膜液与甘油(6%,以干物质含量为基础)混合均匀。随后在功率480 W的超声波清除器中震荡30 min除去气泡。充分混合后,每个样品取60 ml(pH=6)顺玻璃棒倾倒在有机玻璃板上,置入35℃恒温烘箱中6 h,然后放入通风罩中室温下自然干燥24 h,剥离下新形成的膜,保存在温度为25℃和相对湿度为51%干燥器中。
3.3产业现状
交联胶原蛋白在医药、组织工程和生物材料、食品工程领域有着广泛的应用。
在医药方面,交联胶原蛋白可用于制备人工血管、心脏瓣膜和组织修复材料,具有良好的生物相容性和组织接受性。
在组织工程方面,交联胶原蛋白可以作为细胞支架或载体,促进组织再生和修复。
在生物材料方面,交联胶原蛋白常用于制备载药微球、生物贴合剂和组织修复贴片等。
在食品工程方面,交联胶原蛋白常用于肉制品加工中。这是因为胶原蛋白酶交联可以改善肉质的口感和咀嚼性,增加肉制品的弹性和储水性,提高制品的质感和风味。通过交联处理,可以改善肉制品的加工性能,降低加工损失,提高生产效率。
3.4发展前景
随着科学技术的不断发展和人们对食品生物材料的需求增加,交联胶原蛋白作为一种重要的食品生物材料将有更广阔的应用前景。未来,可以进一步优化交联工艺,提高交联效率和产物性能;探索多种酶的交联组合,实现交联产物的多样化和功能化;结合纳米技术和生物功能单元,开发具有特定功能的交联胶原蛋白材料。
四、 结论
酶工程技术为胶原蛋白的应用提供了新的思路和方法,通过各种如酶水解、酶交联等酶技术,拓展了胶原蛋白在食品工程和医药领域的应用范围。未来,随着酶工程技术的不断发展和完善,胶原蛋白的功能性和应用性将会进一步提升,为人类健康和生活带来更多的益处。
参考文献
高贵贤. 2018. 胶原蛋白的酶法交联及成膜特性研究[D]. 天津: 天津科技大学.
全盈园. 2018-11-02. 鱼皮胶原多肽的制备方法[P]. 中国发明专利, CN201810408287.X
王欣慧,崔鹏飞,凡孝菊,等. 胶原蛋白交联方法及其研究进展[J]. 印染, 2024, 50(03): 92-97.
王艳菊. 现代酶工程技术的应用及发展[J]. 生物化工, 2022, 8(04): 178-180.
Buscaglia M, Guerard F, Roquefort P, et al. Mechanically enhanced salmo salar gelatin by enzymatic cross-linking:premise of a bioinspired material for food packaging, cosmetics, and biomedical applications[J]. Marine Biotechnology(New York, N.Y.), 2022, 24(4):801-819.
Eckhard U, Schö������nauer E, Nüss D, et al. Structure of collagenase G reveals a chew-and-digest mechanism of bacterial collagenolysis[J]. Nature Structural & Molecular Biology, 2011, 18(10): 1109-1114.
Eva M, L. R R, H. S T. In Vivo Skin Hydrating Efficacy of Fish Collagen from Greenland Halibut as a High-Value Active Ingredient for Cosmetic Applications[J]. Marine Drugs, 2023, 21(2).
Hu H, Li B, Xue Z, et al. The effect of pacific cod (Gadus macrocephalus) skin gelatin polypeptides on UV radiation induced skin photoaging in ICR mice[J]. Food Chemistry, 2012, 115(3): 945-950.
Patrzykat A, Douglas S E. Antimicrobial peptides: cooperative approaches to protection[J]. Protein and Peptide Letters, 2005, 12 (1): 19-25.
Sharma Rkksks. Involvement of lysyl oxidase in the pathogene⁃��������sis of arterial stiffness in chronic kidney disease[J]. Am J Physiol Renal Physiol, 2023, 324(4):364-373.
Tang C, Zhou K, Zhu Y C, et al. Collagen and its derivatives: From structure and properties to their applications in food industry[J]. Food Hydrocolloids, 2022, 131.
![]()